![]()
Logiciel de simulation des gaz : ATELIER THÉORIE CINÉTIQUE DES GAZ (réalisé par une équipe de didacticiennes de l’Université de Lille). Appelé plus simplement Gaz Chauvet du nom de sa principale conceptrice.
Logiciel parfaitement adapté à l’enseignement, particulièrement au cours de physique Matière (transformation physiques et chimiques de la matière) de 11ème du CO.
Gratuit et très didactique.
Article basé sur la documentation réalisée par Alain Grundish (PG de physique du CO).
Le logiciel Gaz Chauvet ne fonctionne qu’en ligne.
Il fonctionne parfaitement sur les PC et les MAC des configurations scolaires.
Utilisation :
Depuis le site :
Il peut être lancé, par exemple à domicile, dans un navigateur à partir du site : https://www.epi.asso.fr/revue/articles/a0306d/Gaz_a.htm et en cliquant sur le texte actif « sans oscillation » qui figure à la fin du § A.1 dudit site.
Dérouler la page du site jusqu’à l’extrait ci-dessus pour atteindre le texte actif « sans oscillation ».
Il est possible que la sécurité de Java refuse de lancer le logiciel, il vous faudra alors la mettre à jour pour pouvoir utiliser le logiciel à domicile.
Sur le site, on trouve une présentation plus complète du logiciel.
Depuis un poste pédagogique :
Sur un PC sous Kubuntu :
dans le menu des applications (menu K) → Éducation → Sciences → Théorie cinétique des gaz.
Sur un MAC :
dans le Dock cliquez sur Didacticiels → PHYSIQUE → Atelier Théorie cinétique des gaz.
Si une fenêtre de ce type apparaît, cliquez sur Exécuter.
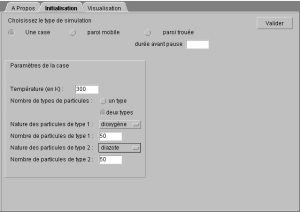
A la fenêtre suivante, cliquez sur Initialisation puis choisissez votre type de simulation et validez.
En suivant une molécule (en rouge) [dioxygène] différente des autres (en vert) [diazote], la simulation aide les élèves à se représenter :
-
l‘agitation moléculaire dans les gaz et les aléas de la progression des molécules au gré des chocs contre les autres molécules et les parois. [une Tp de 300 K est adaptée] ;
-
l’agitation moléculaire comme une agitation qui ne s’arrête pas : les chocs se faisant avec rebond, si une molécule repart moins vite, l’autre repart plus vite [une Tp faible de 50 K est adaptée].
Exemple avec une paroi trouée :
Avec la paroi trouée, la simulation aide les élèves :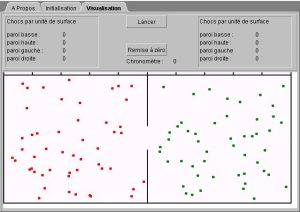
-
à se représenter la diffusion d’un gaz dans un autre ;
-
à distinguer la vitesse des molécules (échelle moléculaire) de la vitesse de la diffusion (échelle humaine) et à expliquer la lenteur de la diffusion relativement à la vitesse énorme des molécules ;
-
à concevoir que, lorsque la diffusion est terminée, l’agitation moléculaire est toujours présente.
Exemple avec une paroi mobile :
Avec la paroi mobile, la simulation aide les élèves :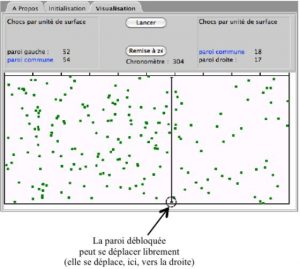
-
à interpréter la pression des gaz par la poussée résultant des chocs moléculaires contre les surfaces (poussée par unité de surface) ;
-
à expliquer les phénomènes d’explosion et d’implosion en prenant en compte la concurrence entre la pression du gaz intérieur et celle du gaz extérieur ;
-
à prédire théoriquement le résultat d’une modification donnée d’un gaz avant de vérifier cette prédiction expérimentalement :
par ex. à prédire le saut du bouchon sous la cloche à vide (modification consistant à enlever de l’air à l’extérieur du tube à essais fermé par un bouchon sans toucher à l’air à l’intérieur du tube) par une diminution de la densité moléculaire à l’extérieur du bouchon, de laquelle découle un abaissement de la fréquence des chocs extérieurs contre le bouchon, et donc un abaissement de la pression à l’extérieur, qui devient en conséquence moins importante qu’à l’intérieur où elle est inchangée ;
par ex. à prédire le saut du bouchon lors du chauffage d’un tube à essais fermé par un bouchon de “patate” (modification consistant à augmenter la température de l’air intérieur du tube à essais sans toucher à l’air extérieur au tube) par une augmentation de l’agitation moléculaire à l’intérieur du tube, de laquelle découle une élévation à la fois de la violence et de la fréquence des chocs intérieurs contre le bouchon, et donc une élévation de la pression à l’intérieur, qui devient en conséquence plus importante qu’à l’extérieur où elle est inchangée ;
-
à expliquer finalement toute variation ou non de la pression d’un gaz en prenant en compte deux facteurs : la fréquence et la violence des chocs moléculaires contre les parois.