Réactions en solution aqueuse
Classe inversée
Séquence en classe inversée permettant d’introduire la notion de pH et de neutralisation, la notion de précipitation et les combinaisons des oxydes avec l’eau.
Temps minimum à prévoir : 1x 45 min + 3x 90 minutes de cours + 1x 45 min pour évaluer
Pré-requis : reconnaître les différentes familles de composés minéraux, savoir dissocier un composé ionique soluble, être capable d’équilibrer une équation de réaction.
OBJECTIFS DE LA SÉQUENCE
Acidité, basicité, pH
- comprendre qu’un acide libère des H+ en solution aqueuse et a un pH inférieur à 7
- comprendre qu’une base (un alcalin) libère des OH- en solution aqueuse, ce qui revient à capter des H+ et a un pH supérieur à 7
- comprendre que la neutralité revient à avoir autant de H+ que de OH- en solution (deux molécules d’eau sur 555 millions dissociées)
- comprendre qu’un acide est toujours acide car toujours soluble
- savoir nommer les acides
- comprendre qu’un hydroxyde est basique s’il est soluble
- comprendre l’utilité et le fonctionnement d’un indicateur coloré
Oxydes dans l’eau
- pouvoir nommer les oxydes de métaux et de non-métaux à partir de leur formule brute
- savoir donner la formule des oxydes de métaux et non-métaux à partir de leur nom
- comprendre qu’un oxyde de métal se combine avec l’eau pour former une hydroxyde tandis qu’un oxyde de non-métal se combine avec l’eau pour former un oxacide
- sachant qu’il ne s’agit pas d’une oxydoréduction, être capable de choisir l’acide formé ou de donner la formule de l’hydroxyde formé
- pouvoir évaluer (<, >,=7) le pH de la solution formée
- pouvoir donner une équation justifiant l’acidification des océans à partir du CO2 de l’air
- être capable de donner une équation justifiant la formation d’acide carbonique à partir du CO2 lors de la gazéification de l’eau ou justifiant la formation de bulles à partir d’eau additionnée d’acide carbonique
- être capable d’expliquer la formation des pluies acides à partir du SO3
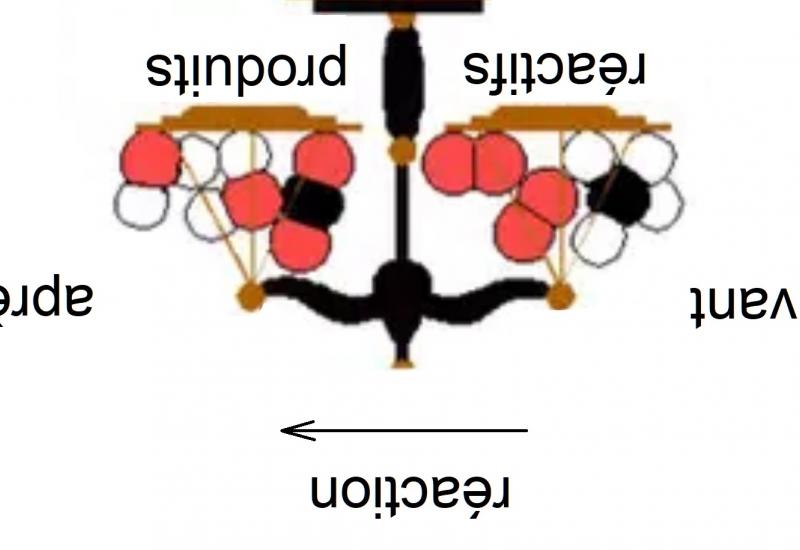
Réactions ioniques
- reconnaître pratiquement la formation d’un précipité
- être capable de compléter une équation globale de réaction de précipitation et donner les équations ionique et ionique réduite (en conséquence savoir déterminer la nature du précipité)
- être capable de compléter une équation de réaction de précipitation dans laquelle un des réactifs est présenté sous la forme d’un ion unique
- être capable de compléter une équation globale de réaction de neutralisation et donner les équations ionique et ionique réduite (comprendre que cette dernière est toujours la même)
- pouvoir représenter avec des modèles nanoscopiques les phénomènes de dissociation, précipitation et neutralisation
PROPOSITION D'ORGANISATION TEMPORELLE
Image
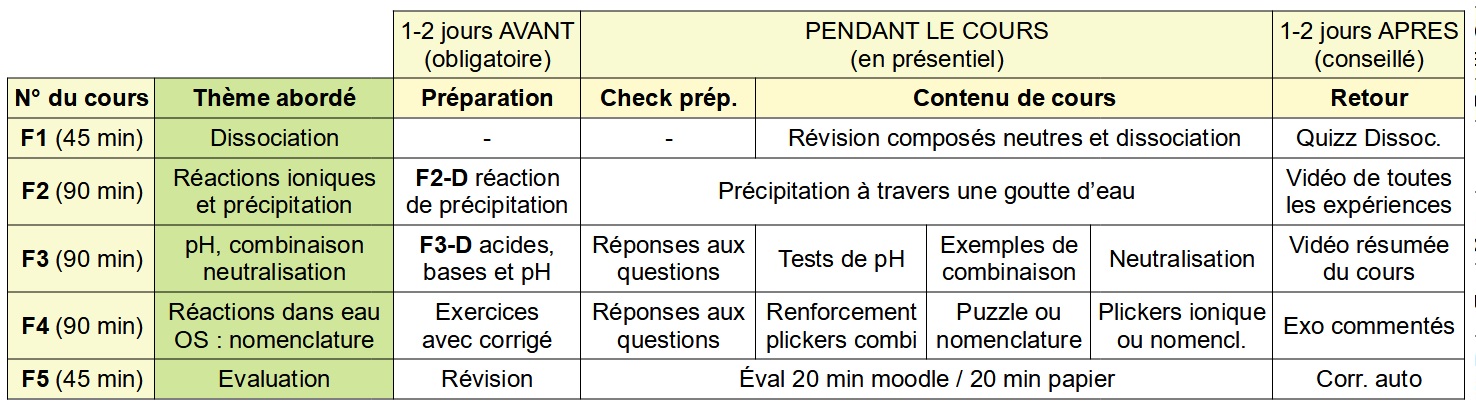
(Idéalement une séance de plus serait souhaitable)
POINTS FORTS DE LA SÉQUENCE
- lien avec le développement durable à travers
- l’acidification des océans
- la formation des pluies acides
- expérience micro
- limitant la quantité de réactifs utilisés
- permettant la visualisation de la dissociation avant la précipitation
- amenant l’utilisation du numérique (film à présenter)
- test de pH sur des substances du quotidien
- évaluation formative
et comme d’habitude
- vidéo introductive pour des devoir de 20 min max
- résumé théorique succinct à disposition des élèves
- exemples d’exercices en format vidéo
- exercices corrigés
MATÉRIEL PÉDAGOGIQUE
Le support résumé avec les énoncés d'exercices, les corrigés écrits des exercices ainsi que les descriptifs de cours sont disponibles en haut de la page à droite dans la zone téléchargement. Pour les enseignants genevois, vous avez aussi directement accès à la partie moodle (détail ci-dessous après vous être connecté). Pour les autres enseignants intéressés, vous pouvez demander à recevoir le fichier mbz en écrivant à l'adresse email valerie.geretto (at) edu.ge.ch.